
聯系熱線
1月5日,國家藥監局官網發布公告顯示,按照《醫療器械監督管理條例》《醫療器械分類目錄動態調整工作程序》有關要求,結合醫療器械產業發展和監管工作實際,國家藥監局決定對《醫療器械分類目錄》部分內容進行調整。
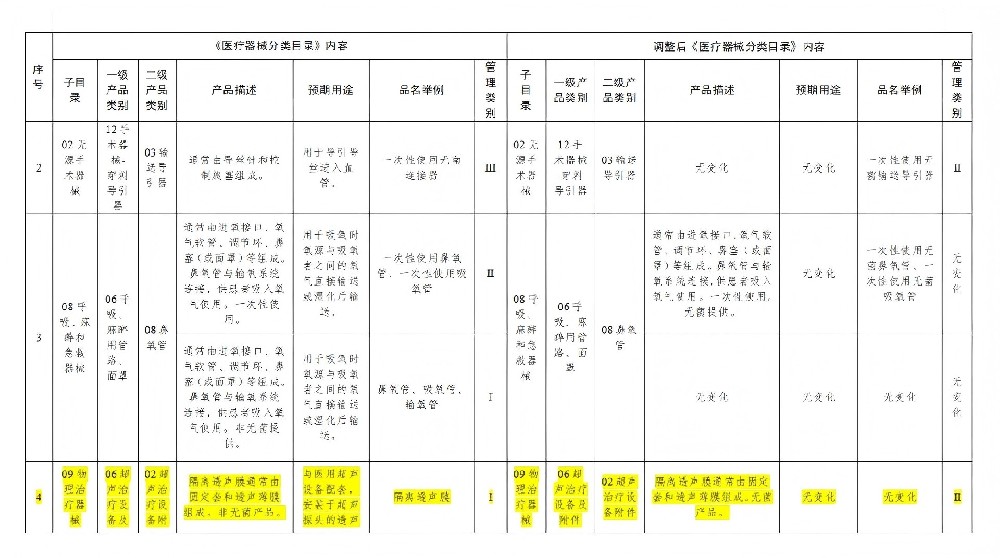
此次調整涉及無源手術器械、物理治療器械、口腔科器械、無源植入器械等10個子目錄的31類產品,調整內容包括產品描述、預期用途、品名舉例,部分產品的管理類別同時調整。例如,輸送導引器的品名舉例由“一次性使用無菌連接器”調整為“一次性使用無菌輸送導引器”,管理類別由第三類降低為第二類;超聲治療設備附件的產品描述在原有非無菌產品的基礎上增加了無菌產品的描述,非無菌產品的管理類別依然為第一類,無菌產品的管理類別為第二類。
管理類別下調(降低監管強度)
這類調整主要針對一些技術成熟、臨床應用經驗豐富、風險認知更清晰的產品,使其監管級別與當前風險水平更匹配,可以減輕企業合規負擔。
具體示例:手動輪椅車從Ⅱ類調整為I類管理。
新增及明確創新醫療器械
為近年來涌現的創新技術產品明確分類,使其納入規范的監管體系,支持創新產品上市。
具體示例:在“閉合夾”中增加了“可降解鎂金屬閉合夾”;新增了“肌腱修復補片”、“可吸收肩袖修復隔離膜”、“中耳通氣管”等細分品類。
管理類別上調(加強監管)
對個別產品因風險認知變化或技術發展,適當提升了監管級別,以確保安全。
具體示例:隔離透聲膜(無菌產品)從I類調整為Ⅱ類。
公告全文
一、調整內容
對31類醫療器械涉及《醫療器械分類目錄》內容進行調整,具體調整內容見附件。
二、實施要求
(一)自本公告發布之日起,藥品監督管理部門依據《醫療器械注冊與備案管理辦法》《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告》《關于第一類醫療器械備案有關事項的公告》等,按照調整后的類別受理醫療器械注冊申請或者辦理備案。
對于已受理尚未完成注冊審批(包括首次注冊和延續注冊)的醫療器械,藥品監督管理部門繼續按照原受理類別審評審批,準予注冊的,核發醫療器械注冊證,并在注冊證備注欄注明調整后的產品管理類別。
對于已注冊的醫療器械,其管理類別由第三類調整為第二類的,醫療器械注冊證在有效期內繼續有效。如需延續的,注冊人應當在醫療器械注冊證有效期屆滿6個月前,按照改變后的類別向相應藥品監督管理部門申請延續注冊,準予延續注冊的,按照調整后的產品管理類別核發醫療器械注冊證。
對于已注冊的醫療器械,其管理類別由第二類調整為第一類的,醫療器械注冊證在有效期內繼續有效。注冊證到期前,注冊人應當向相應部門辦理產品備案。
醫療器械注冊證有效期內發生注冊變更的,注冊人應當向原注冊部門申請變更注冊。如原注冊證未按照原《醫療器械分類目錄》核發,本公告涉及產品的變更注冊文件備注欄中應當注明公告實施后的產品管理類別。
(二)各級藥品監督管理部門要加強《醫療器械分類目錄》內容調整的宣貫培訓,切實做好相關產品審評審批、備案和上市后監管工作。
國家藥監局
2025年12月30日